 |
能不能仔細的解釋為什麼石墨能導電而同樣純碳構成的鑽石不能導電呢?(題庫裡有相同的問題,但是解釋的太模糊了啦)
(台北/某中學/高中生/瞇瞇) |
小胡桃姐姐:-
- 鑽石和石墨同樣是由碳所構成(同是碳的同素異構物),但是前者無法導電,後者卻能導電,是因為他們結構中碳原子的排列方式不同所致。
如下圖,石墨是由碳形成分層的平面結構,而鑽石卻像是立體的網狀結構。
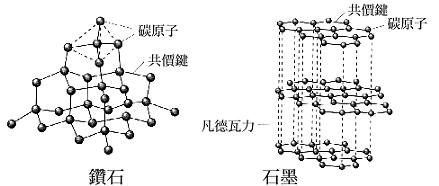
-
-
- 一般碳原子的外圍有四個電子,在石墨的結構中我們可以看到,其中三個電子分別與另三個碳原子的一個電子共用,剩下的一個電子則成為「自由電子」!因此可以導電。但是在鑽石的結構中,碳的四個電子都分別其他四個碳原子的一個電子共用,因此沒有自由電子,也就無法導電啦!
|
|